Определение хпк в сточной воде методика. Органические загрязнители, бпк и хпк
Одним из наиболее распространенных методов оценки степени загрязненности сточных вод является показатель ХПК (химическое поглощение кислорода - Лурье Ю. Ю. Аналитическая химия промышленных сточных вод.- М.: Химия, 1984.)
В СССР в качестве арбитражного был принят бихроматный метод определения ХПК. Однако этот метод длителен (около 6 ч) и требует большого расхода серной кислоты (165 мл на каждый анализ), поэтому он мало пригоден для массовых анализов в заводских лабораториях и на станциях очистки сточных вод.
Существуют более простые ускоренные варианты этого метода, дающие, однако, несколько заниженные результаты по сравнению с арбитражным методом. Кроме того, известные ускоренные методы не унифицированы и нуждаются в корректировке применительно к исследуемым стокам разных производств.
Нами исследованы среднесуточные стоки различных пивзаводов: Харьковских № 1 и № 2, Изюмского, Купянского, Полтавского, Мелитопольского и Белгородского.
Были изучены оптимальные условия окисления сточных вод растворами бихромата калия и предложена ускоренная методика определения ХПК, по которой на анализ затрачивается около 20 мин, расход серной кислоты составляет 45 мл на одну пробу воды.
Учитывая, что результаты определения ХПК ускоренным методом несколько ниже, получаемых арбитражным методом, представляло интерес установить соотношение между величинами ХПК, найденными двумя методами, и, таким образом, внести корректировку в расчет при анализе ХПК ускоренным методом.
В пробах сточных вод определяли ХПК двумя методами. Зависимость между показателями ХПК, найденную ускоренным (х) и арбитражным (у) методами, выражали в графической форме. Для этого в общем уравнении линейной регрессии У=а+Ьх определяли коэффициенты а и Ь решением системы из двух уравнений:
| { | an + bΣx=Σy |
| aΣx + bΣx 2 =Σxy |
где n - число определений ХПК.
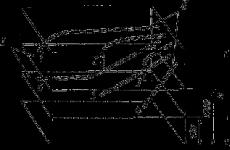
Было найдено, что а= -18,5; Ь = - 1,18 (или -1,2). Подставив эти значения в общее уравнение линейной регрессии, получили уравнение (см. рисунок), связывающее значения ХПК, определенные двумя методами:
у = 1,2x - 18,5.
Для определения ХПК разработанным ускоренным методом в коническую колбу объемом 250 мл отбирали пипеткой 5 мл сточной воды (если ХПК сточной воды выше 600 мг О 2 /л , сточную воду перед анализом разбавляли в 2 или более раз дистиллированной водой) , вносили в колбу 5 мл 0,1 н. раствора К 2 Сr 2 О 7 и при помешивании постепенно добавляли 15 мл концентрированной серной кислоты. Через 2 мин раствор охлаждали до комнатной температуры, приливали 50 мл дистиллированной воды, 3-4 капли индикатора (0,1 %-ного раствора фенилантраниловой кислоты) и титровали 0,1 н. раствором соли Мора.
Ежедневно перед анализом сточной воды проверяли титр раствора соли Мора.
Одновременно с анализом опытного образца делали холостой опыт, для чего брали 5 мл дистиллированной воды и проводили все ступени анализа.
ХПК определяли по формуле:
ХПК = 1,2 · ((V 0 - V) · 0,1 · K · 8 · 1000 / a) - 18,5
Где
V 0 , V - соответственно объемы раствора соли Мора, пошедшие на титрование холостой и опытной проб, мл; 0,1 - нормальность раствора соли Мора;К - поправочный коэффициент для приведения раствора соли Мора к 0,1 н.;
8 - эквивалент кислорода;
А - объем анализируемой сточной воды, мл;
1,2 и 18,4 - коэффициенты для приведения данных ускоренного к показателям арбитражного метода определения ХПК.
График зависимости между величинами ХПК сточных вод, найденных ускоренным (х) и арбитражным (у) методами
|
Определено ХПК, мг О 2 /л |
x/y = z |
z 1 - z |
(z 1 - z ) 2 |
|
|
разработанным методом (х) |
арбитражным методом (у) |
|||
|
Σ =15,01 |
Σ =0,0853 |
|||
|
Примечание: z = Σ z /n=1 |
||||
Для оценки точности разработанного метода определения ХПК по данным, приведенным в таблице, находили:
S 2 = Σ (z 1 - z) 2 / (n - 1);
E = + t a · S z
E отн = + E · 100 / 2
где n - число определений ХПК;
z - среднее арифметическое из n определений;
S 2 - выборочная дисперсия метода при данном числе определений;
S z - средняя квадратичная ошибка среднего значения;
а - заданная надежность;
t a - множитель, который находят в специальных таблицах по математической статистике по величинам а и n;
Е - точность определения;
E отн - относительная погрешность метода в %.
Величина S z =0,061, Е=0,044, E отн =4,4%. Таким образом, разработанный метод определения ХПК в сточных водах пивзаводов намного быстрее арбитражного и требует меньшего расхода концентрированной серной кислоты. Относительная погрешность метода составляет ±4,4 %.
Введение
В воде источников водоснабжения обнаружено несколько тысяч органических веществ разных химических классов и групп. Органические соединения природного происхождения (гуминовые вещества, различные амины и другие) - способны изменять органолептические свойства воды, и по этой причине они должны быть удалены в процессе водоподготовки.
Несомненно, что органические вещества техногенного происхождения при поступлении их с питьевой водой могут неблагоприятно действовать на организм. Аналитический контроль их содержания в питьевой воде затруднен не только ввиду громадного их числа, но и вследствие того, что многие из них весьма неустойчивы и в воде происходит их непрерывная трансформация. Поэтому при аналитическом контроле невозможно идентифицировать все органические соединения, присутствующие в питьевой воде.
Однако многие органические вещества обладают выраженными органолептическими свойствами (запахом, вкусом, цветом, способностью к пенообразованию), что позволяет их выявить и ограничить их содержание в питьевой воде. Примерами таких веществ являются: синтетические поверхностно-активные вещества (СПАВ), в незначительных (нетоксических) концентрациях образующие пену; фенолы, придающие воде специфический запах; многие фосфорорганические соединения.

В природной воде водоемов всегда присутствуют органические вещества. Их концентрации могут быть иногда очень малы (например, в родниковых и талых водах). Природными источниками органических веществ являются разрушающиеся останки организмов растительного и животного происхождения, как живших в воде, так и попавших в водоем с листвы, по воздуху, с берегов. Кроме природных, существуют также техногенные источники органических веществ: транспортные предприятия (нефтепродукты), целлюлозно-бумажные и лесоперерабатывающие комбинаты (лигнины), мясокомбинаты (белковые соединения), сельскохозяйственные и фекальные стоки и т.д. Органические загрязнения попадают в водоем разными путями, главным образом со сточными водами и дождевыми поверхностными смывами с почвы.
БПК и ХПК
Интегральное содержание органических веществ оценивается по показателям БПК и ХПК.
Биохимическое и химическое потребление кислорода - БПК и ХПК , принятые в гигиене, гидрохимии и экологии, интегральные показатели, характеризующие содержание в воде нестабильных (неконсервативных) органических веществ, трансформирующихся в воде путем гидролиза, окисления и других процессов. Содержание таких веществ выражается через количество кислорода, необходимое для их окисления в резко кислой среде перманганатом (БПК) или бихроматом (ХПК). К таким веществам относят алифатические кислоты, некоторые эфиры, амины, спирты.
В естественных условиях находящиеся в воде органические вещества разрушаются бактериями, претерпевая аэробное биохимическое окисление с образованием CO 2 . При этом на окисление потребляется растворенный в воде кислород (РК). В водоемах с большим содержанием органических веществ большая часть кислородапотребляется на биохимическое окисление, лишая, таким образом, кислорода другие организмы. Поэтому увеличивается количество организмов, более устойчивых к низкому содержанию кислорода, исчезают кислородолюбивые виды. Таким образом, в процессе биохимического окисления органических веществ в воде происходит уменьшение концентрации кислорода, и эта убыль косвенно является мерой содержания в воде органических веществ. Соответствующий показатель качества воды, характеризующий суммарное содержание в воде органических веществ, называется биохимическим потреблением кислорода (БПК).
БПК - это количество кислорода в (мг), требуемое для окисления находящихся в 1 литре воды органических вещества в аэробных условиях, без доступа света, при 20 °С, за определённый период в результате протекающих в воде биохимических процессов.
Определение БПК основано на измерении концентрации РК в пробе воды непосредственно после отбора, а также после инкубации пробы. Инкубацию пробы проводят без доступа воздуха в кислородной склянке (то есть в той же посуде, где определяется значение РК) в течение времени, необходимого для протекания реакции биохимического окисления. Так как скорость биохимической реакции зависит от температуры, инкубацию проводят в режиме постоянной температуры (20±1) °С, причем от точности поддержания значения температуры зависит точность выполнения анализа на БПК. Обычно определяют БПК за 5 суток инкубации (БПК 5). Может определяться также БПК 10 за 10 суток и БПК полн. за 20 суток (при этом окисляется около 90 % и 99 % органических веществ соответственно). Ориентировочно принимают, что БПК 5 составляет около 70 % БПК полн. , но может составлять от 10 % до 90 % в зависимости от окисляющегося вещества. Погрешность в определении БПК может внести также освещение пробы, влияющее на жизнедеятельность микроорганизмов и способное в некоторых случаях вызывать фотохимическое окисление. Поэтому инкубацию пробы проводят без доступа света.
В поверхностных водах величина БПК 5 колеблется в пределах от 0,5 до 5,0 мг/л; она подвержена сезонным и суточным изменениям, которые, в основном, зависят от изменения температуры и от физиологической и биохимической активности микроорганизмов. Весьма значительны изменения БПК 5 природных водоемов при загрязнении сточными водами.
Таблица 1. Величины БПК 5 в водоемах с различной степенью загрязненности
Норматив на БПК полн. не должен превышать: для водоемов хозяйственно-питьевого водопользования - 3 мг/л для водоемов культурно-бытового водопользования - 6 мг/л. Соответственно можно оценить предельно-допустимые значения БПК 5 для тех же водоемов, равные 2 мг/л и 4 мг/л.

Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется окисляемостью или ХПК . Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая.
Являясь интегральным (суммарным) показателем, ХПК в настоящее время считается одним из наиболее информативных показателей антропогенного загрязнения вод. Этот показатель, в том или ином варианте, используется повсеместно при контроле качества природных вод, исследовании сточных вод и др. Результаты определения окисляемости выражаются в миллиграммах потребленного кислорода на 1 литр воды (мгО/л).
В водоемах и водотоках, подверженных сильному воздействию хозяйственной деятельности человека, изменение окисляемости выступает как характеристика, отражающая режим поступления сточных вод. Для природных малозагрязненных вод рекомендовано определять перманганатную окисляемость ; в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О/дм 3 ; в зонах рекреации в водных объектах допускается величина ХПК до 30 мг О/дм 3 .
В программах мониторинга ХПК используется в качестве меры содержания органического вещества в пробе, которое подвержено окислению сильным химическим окислителем. ХПК применяют для характеристики состояния водотоков и водоемов, поступления бытовых и (в том числе, и степени их очистки), а также поверхностного стока.
Таблица 2. Величины ХПК в водоемах с различной степенью загрязненности
Однако не все органические вещества в равной степени участвуют в реакции химического окисления. Так же, как и при биохимическом окислении, при химическом окислении можно выделить группы легко, нормально и тяжело окисляющихся органических веществ. Поэтому всегда существует разница между теоретически возможным и практически достигаемым значениями ХПК. Мешают точному определению ХПК в первую очередь, хлорид-анионы, как правило, содержащиеся в природных и, особенно, в сточных водах. Определению также мешают нитриты, часто присутствующие в водах, прошедших биохимическую очистку.
Нормативы на ХПК в воде водоемов: для питьевой воды – 5,0 мгО/л (для перманганатной окисляемости), ХПК – 15 мгО/л.
Для оценки загрязнения воды органическими соединениями используется величина БПК, однако, для определения БПК необходимо 5 суток, а иногда данные требуются гораздо быстрее. В этом случае вместо микроорганизмов для окисления органических веществ используют бихромат калия в присутствии серной кислоты (при нагревании). Эта смесь окисляет практически все органические вещества, содержащиеся в загрязненной воде. Величину, характеризующую содержание в воде органических веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называют химическим потреблением кислорода (ХПК) или окисляемостью воды. ХПК выражается в миллиграммах кислорода, пошедшего на окисление веществ, содержащихся в 1 дм 3 воды. Метод определения – титриметрический.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О 2 /дм 3 ; в зонах рекреации в водных объектах допускается величина ХПК до 30 мг О 2 /дм 3 .
Растворенный кислород
Растворенный кислород находится в природной воде в виде молекул O 2 . На его содержание в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее. К первой группе процессов, обогащающих воду кислородом, следует отнести:
процесс абсорбции кислорода из атмосферы;
выделение кислорода водной растительностью в процессе фотосинтеза;
поступление в водоемы с дождевыми и снеговыми водами, которые обычно пересыщены кислородом.
Абсорбция кислорода из атмосферы происходит на поверхности водного объекта. Скорость этого процесса повышается с понижением температуры, с повышением давления и понижением минерализации. Аэрация – обогащение глубинных слоев воды кислородом – происходит в результате перемешивания водных масс, в том числе ветрового, вертикальной температурной циркуляции и т.д.
Выделение кислорода в результате фотосинтеза происходит при ассимиляции диоксида углерода водной растительностью (прикрепленными, плавающими растениями и фитопланктоном). Процесс фотосинтеза протекает тем сильнее, чем выше температура воды, интенсивность солнечного освещения и больше биогенных (питательных) веществ (P ,N и др.) в воде. Продуцирование кислорода происходит в поверхностном слое водоема, глубина которого зависит от прозрачности воды (для каждого водоема и сезона может быть различной, от нескольких сантиметров до нескольких десятков метров).
К группе процессов, уменьшающих содержание кислорода в воде, относятся реакции потребления его на окисление органических веществ: биологическое (дыхание организмов), биохимическое (дыхание бактерий, расход кислорода при разложении органических веществ) и химическое (окисление Fe 2+ ,Mn 2+ ,NO 2 - ,NH 4 + ,CH 4 ,H 2 S ). Скорость потребления кислорода увеличивается с повышением температуры, количества бактерий и других водных организмов и веществ, подвергающихся химическому и биохимическому окислению. Кроме того, уменьшение содержания кислорода в воде может происходить вследствие выделения его в атмосферу из поверхностных слоев и только в том случае, если вода при данных температуре и давлении окажется пересыщенной кислородом.
В поверхностных водах содержание растворенного кислорода варьирует в широких пределах – от 0 до 14 мг/дм 3 – и подвержено сезонным и суточным колебаниям. Суточные колебания зависят от интенсивности процессов его продуцирования и потребления и могут достигать 2,5 мг/дм 3 растворенного кислорода. Дефицит кислорода чаще наблюдается в водных объектах с высокими концентрациями загрязняющих органических веществ и в эвтрофированных водоемах, содержащих большое количество биогенных и гумусовых веществ.
Концентрация кислорода определяет величину окислительно-восстановительного потенциала и в значительной мере направление и скорость процессов химического и биохимического окисления органических и неорганических соединений. Кислородный режим оказывает глубокое влияние на жизнь водоема. Минимальное содержание растворенного кислорода, обеспечивающее нормальное развитие рыб, составляет около 5 мг/дм 3 . Понижение его до 2 мг/дм 3 вызывает массовую гибель (замор) рыбы.
|
Уровень загрязненности воды и класс качества |
Растворенный кислород |
||
|
лето, мг/дм 3 |
зима, мг/дм 3 |
% насыщения |
|
|
Очень чистые, I | |||
|
Чистые, II | |||
|
Умеренно загрязненные, III | |||
|
Загрязненные, IV | |||
|
Грязные, V | |||
|
Очень грязные, VI | |||
Относительное содержание кислорода в воде, выраженное в процентах его нормального содержания, называется степенью насыщения кислородом. Эта величина зависит от температуры воды, атмосферного давления и солености. Вычисляется по формуле:
M = ,
где M – степень насыщения воды кислородом, %;а – концентрация кислорода, мг/дм 3 ;Р – атмосферное давление в данной местности, Па;N – нормальная концентрация кислорода при данной температуре, минерализации (солености) и общем давлении 101308 Па.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого и санитарного водопользования содержание растворенного кислорода в пробе, отобранной до 12 часов дня, не должно быть ниже 4 мг/дм 3 в любой период года; для водоемов рыбохозяйственного назначения концентрация растворенного в воде кислорода не должна быть ниже 4 мг/дм 3 в зимний период (при ледоставе) и 6 мг/дм 3 – в летний.
Определение бихроматной окисляемости (химического потребления кислорода или ХПК) в пробах сточных вод фотометрическим методом производится согласно методике . Метод измерения основан на обработке пробы воды серной кислотой и бихроматом калия при температуре 150° С.
Перед отбором пробы воду тщательно перемешивают. Одновременно анализируют не менее двух аликвот пробы воды (параллельные пробы).
Аликвоты, объемом 2 мл, помещают в стеклянные виалы, заполненные реагентом, приготовленным в зависимости от ожидаемого значения ХПК пробы (в диапазоне от 5 до 80 мгО/л или от 80 до 800 мгО/л). Виалы плотно закрывают завинчивающимися крышками и перемешивают растворы. Помещают виалы в термореактор «Термион», предварительно нагретый до температуры 150°С, и выдерживают в течение двух часов. Осторожно вынимают съемную часть штатива термореактора вместе со всеми виалами и охлаждают в вытяжном шкафу. Через 20 минут содержимое виал перемешивают и охлаждают до комнатной температуры.
Перед измерением наружные поверхности стеклянных виал протирают сухой салфеткой. Виалу с исследуемым раствором помещают в кюветное отделение анализатора «Флюорат-02-3М». Определяют значение ХПК в режиме измерение. Измерение оптической плотности раствора проводят в диапазоне длин волн от 340 до 380 нм в зависимости от ожидаемых значений ХПК. Полученные значения результатов измерений заносят в лабораторный журнал. Результаты измерений представляют в виде:
Х ± U, мгО/л
где Х – среднее арифметическое значение концентрации ХПК, мгО/л;
U – расширенная неопределенность измерений с коэффициентом охвата k=2 дляn=2 параллельных определений, мгО/л.
U= 0,01·U отн ·
где U отн – значение расширенной относительной неопределенности при коэффициенте охватаk=2 (приложение Б).
Результат анализа округляют с точностью:
при полученном значении ХПК
от 1,0 до 10,0 мгО/л – до 0,1 мгО/л;
от 10 до 100 мгО/л – до 1 мгО/л;
от 100 до 1000 мгО/л – до 10 мгО/л.
При получении двух результатов измерений (Х 1 , Х 2) осуществляют проверку приемлемости результатов в соответствии с требованиями .
Результат измерений считают приемлемым при выполнении условия:
где Х max - больший результат параллельного определения, мгО/л;
Х min - меньший результат параллельного определения, мгО/л;
Х – среднее арифметическое результатов параллельных определений, мгО/л;
r– значение предела повторяемости (приложение Б).
3. Определение концентрации бпк5
Метод определения БПК основан на способности микроорганизмов потреблять растворенный кислород при биохимическом окислении органических и неорганических веществ в воде.
Биохимическое потребление кислорода определяют количеством кислорода, которое потребуется для окисления находящихся в воде углеродсодержащих органических веществ в аэробных условиях в результате биохимических процессов.
При определении биохимического потребления кислорода (БПК) в пробах сточных вод скляночным методом согласно методике , значение БПК устанавливается по разности содержания растворенного кислорода в обогащенной растворенным кислородом и зараженной аэробными микроорганизмами пробе воды до и после инкубации.
Определение биохимического потребления кислорода (БПК) манометрическим методом согласно методике основано на измерении разности давления в замкнутой БПК системе, состоящей из бутыли для инкубации с зараженной аэробными микроорганизмами пробой и БПК-сенсора, до и после инкубации.
2.2.3. Определение ХПК в сточных водах.
Окисляемость- общее количество содержащихся в воде восстановителей (неорганических и органических), реагирующих с сильными окислителями, например, бихроматом, перманганатом и др. Наиболее полное окисление достигается бихроматом калия, поэтому бихроматную окисляемость нередко называют «химическим потреблением кислорода(ХПК). Это основной метод определения окисляемости. Большинство соединений окисляется при этом на 95-100%. Однако есть небольшое число соединений (бензол, толуол, пиридин и др), которые совсем не окисляются бихроматом калия даже в присутствии катализатора. Окисление органических веществ бихроматом происходит до образования диоксида углерода и воды, азот выделяется в виде газа./42/
В 50% по объму серной кислоте бихромат калия при кипячении действует как сильный окислитель, особенно при использовании в качестве катализатора сульфата серебра. После окисления избыток бихромата находят титорованием раствором соли Мора.
Метод позволяет определить окисляемость от 15 мгО/л и выше при применении 0,1 н. раствора бихромата калия и от 5 до 50 мгО/л при использовании 0,05 н.раствора.
Ход определения.
В отсутствии хлоридов. Отбират порцию воды, чтобы на ее окисление расходовалось около 50% раствора бихромата калия, разбавляют ее дистиллированной водой, переносят в круглодонную колбу вместимость 300 мл, прибавляют 10 мл 0,1 н. бихромата калия и осторожно, малыми порциями, тщательно перемешивая смесь после дбавления каждой порции, 30 мл серной кислоты. Затем добавляют 0,3-).4 г. Сульфата серебра, вводят в колбу несколько стеклянных капилляров, присоединяют к обратному холодильнику, нагревают до слабого кипения и кипятят 2 часа. Затем охлаждают, обмывают стенки холодильника 25 мл дистиллированной воды и переносят содержимое колбы в коническую колбу вместимостью 500 мл, доводя объем до 350 мл. Вводят 4-5 капель феррона или 10-15 капель N- фенилантраниловой кислоты и оттитровывают избыток бихромаьа калия солью Мора.
Если в анализируемой воде содержатся хлориды, то можно проводить определение, не добавляя катализатор сульфат серебра. Хлориды-ионы окисляются до свободного хлора.
Для холостого опыта берут 20 мл дистиллированной воды и проводят ее через все ступени анализа.
Величину ХПК (мг О/л) вычисляют по формуле:
ХПК = (А – В) н К 8 1000
где А и В – объем растворов соли Мора, израсходованных на титрование холостого опыта и пробы, мл;
Н – нормальность раствора соли Мора;
К – поправоный коэффициент к титру раствора соли Мора;
V – объем анализируемой воды, мл;
8 – эквивалент кислорода.
2.2.4. Определение нефтепродуктов в сточных водах методом ИКС.
Нефтепродукты относятся к числу наиболее распространенных загрязняющих веществ. В воде находятся в различных миграционных формах- растворенный, эмульгированный, сорбированный на взвешенных частицах, в виде пленки. Нефтепродукты при анализе воды условно принято считать только неполярные и малополярные углеводороды, растворимые в гексане, т.е сумму алифатических, нафтеновых, ароматических углеводородв, составляющих основную часть нефти./42,43/
Метод определения нефтепродуктов заключается в экстракции эмульгированных и растворенных нефтепродуктов из воды четыреххлористым углеродом: отделение нефтепродуктов от сопутствующих органических соединений других классов на колонке, заполненной оксидом алюминия и измерением массовой концентрации нефтепродуктов методом ИК-спектрометрии.
Ход определения.
В сосуд с пробой воды приливают серную кислоту из расчета 2 см3 кислоты на 100 см3 пробы и переносят пробу в экстратор. Сосуд, в котором была проба ополаскивают 10 см3 четыреххлористого углерода и добавляют этот растворитель в экстратор. Прибавляют еще 20 см3 СCL4 и включают экстрактор на 4 мин, отстаивают эмульсию в течение 10 мин. После расслоения эмульсии нижний слой сливают в цилиндр вместимостью 100 см3. Экстракт сушат безводным сульфатом натрия в течение 30 мин. После чего экстракт осторожно сливают в цилиндр вместимостью 50 мл.
В подготовленную хроматографическую колонку наливают 8 см3 СCL4 для смачивания, а затем промывают 5 мл этого растворителя. Как только раствор достигнет верхнего уровня оксида алюминия, в колонку вливают небольшими порциями подготовленный экстракт, собирают элюат в мерную колбу вместимостью 50 см3, пропуская в конце хроматографирования чистый растворитель. Измеряют объем элюата. Элюат заливают в кювету и устанавливают в прибор АН-1 или КН-1. Фиксируют показания прибора, соответствующие количеству нефтепродуктов в 1 см3 элюата. Концентрацию нефтепродуктов (мг/дм3) воде вычисляют по формуле:
С = С изм. В К
где С изм – содержание нефтепродуктов в элюате, измеренное на приборе;
В – объем экстракта, пошедшего на анализ, см3;
V – объем пробы воды, взятой для определения, см3;
К – коэффициент разбавления элюанта.




Концентрация пыли в выбросах цеха снизится и будет находится в пределах показателя ПДВ или будет превышать его незначительно. 6.3 Описание технологической схемы очистки выбросов цеха литья пластмасс В цехе литья пластмасс основными источниками загрязнения атмосферного воздуха являются термопластавтоматы в количестве 12 штук и сушильные шкафы, в которых ведется подготовка материала к...





Соль. Это позволяет улучшить органолептические показатели, увеличить сроки хранения и годности и расширить ассортимент консервированных геродиетических продуктов. 2.Технология производства мясорастительного паштета Рис.1 Технологическая схема производства мясорастительного паштета. Подготовка основного сырья. Растительное сырье. Нут после приемки осматривают, счищают от примесей и...




Для смягчения влияния одного ограничения, администратор базового проекта корректирует вручную базу данных персонала. 3.2 Направления совершенствования анализа финансовых результатов деятельности предприятия Цены на услуги ЗАО «ЧЕЛНЫВОДОКАНАЛ» устанавливаются Кабинетом Министров (КМ) Республики Татарстан. Объемы выпуска продукции ЗАО «ЧЕЛНЫВОДОКАНАЛ» плавно снижаются по объективным причинам...
... (обработка минеральными солями и кислотами, коагулянтами и флокулянтами); физико-химические (электрокоагуляция, ультрафильтрация). Метод деэмульгирования масляных эмульсий путем коагуляции дисперсной фазы неорганическими электролитами получил широкое распространение в практике очистки сточных вод. По литературным данным, для очистки маслоэмульсионных сточных вод могут быть использованы NaCl, ...